第5のがん治療法とは
第5のがん治療法とは、がん細胞が積極的に取り込む「トロイの木馬」分子にがん細胞を退治する「武器」の機能をもつ分子を先導させて、がんを治療する方法です。「武器」分子は、さまざまな物理学的、あるいは化学的な方法を用いて活性化させます。
最初に、近年起き始めたがん治療の進化を概観します。
従来の3つのがん治療法(第1の方法=「外科手術」、第2の方法=「抗がん剤などの薬物療法」、第3の方法=「放射線療法」)からなる標準治療に加えて、第4の方法=「免疫療法」(*1)が、本庶佑博士(現在京都大学・特別教授, 2018年ノーベル賞受賞)によって劇的な進化をとげました。これは、免疫を抑制するレセプターに蓋をするというやり方で免疫を活性化して治療効果を発揮するものです。
さらに近年、「光免疫療法」(*2)や「ホウ素中性子捕捉療法(BNCT)」(*3)が、やはり日本人の手で実用化されました。これらは「第5のがん治療法」と呼ばれます。その際立った特徴は、がん細胞に選択的に結合し、あるいは取り込まれる分子とがん細胞にダメージを与える分子との結合物質を用いるということです。トロイア戦争でギリシア軍がトロイア軍を攻略するため、武器をもつ兵をひそませて侵入させた「トロイの木馬」(*4)に倣うと、がん細胞が結合する、あるいは細胞内に取り込む「木馬」分子に「武器」となる分子を先導させる、という方法に他なりません【図1】。「木馬」分子と「武器」分子とは強い化学結合でつながっていて、たやすく切れません。
強い化学結合による結び付き

【図1】 第5のがん治療法を「トロイの木馬」に倣って示す
オルバイオ法とは
オルバイオ法とは、「トロイの木馬」分子としてL-グルコースを用い、それに強い化学結合で細胞毒性を発揮する「武器」分子をつないで、既存の抗がん剤に比べ、はるかに高い選択性でがん細胞にその「武器」分子を取り込ませたのち、「武器」分子の毒性を発揮させ、あるいは積極的に物理学的な方法を用いることにより「武器」分子を活性化させて、悪性腫瘍細胞を壊し、がんを制御する方法です。
ブドウ糖として知られているD-グルコース(【図2】の右)はほぼすべての細胞が最も重要な栄養素、エネルギー源として利用します。一方、その鏡写しの分子であるL-グルコース(【図2】の左)は自然界にほとんど見られず、仮に合成して細胞に与えても細胞はこれを栄養素として細胞内に取り込みません。
ところが「がん細胞はこのL-グルコースに蛍光基を結合した分子を栄養素であるかのように、細胞内に取り込む」ことを、山田勝也博士(現在弘前大学・オルバイオ共同研究講座特任教授)らが見出しました。山田博士らは、L-グルコースに、緑色に光る蛍光基を結合させた蛍光L-グルコースを用いて偶然この現象を発見しました。
さらに、蛍光基を青色に光る分子に変えたところ、がん細胞に取り込まれるのみならず、さらにがん細胞の核に取り込まれることがわかりました。蛍光基を結合したL-グルコースは、膵臓がん・胆道がん・卵巣がんなど難治性の腺がん、および肉腫において、特に選択的にがん細胞に取り込まれることがわかり、形態異常、遺伝子異常や特異抗体の発現といった静的な情報に基づく方法とは異なるがん細胞の動態を捉える全く新しい診断方法が提案されました。
鏡写しの化学構造
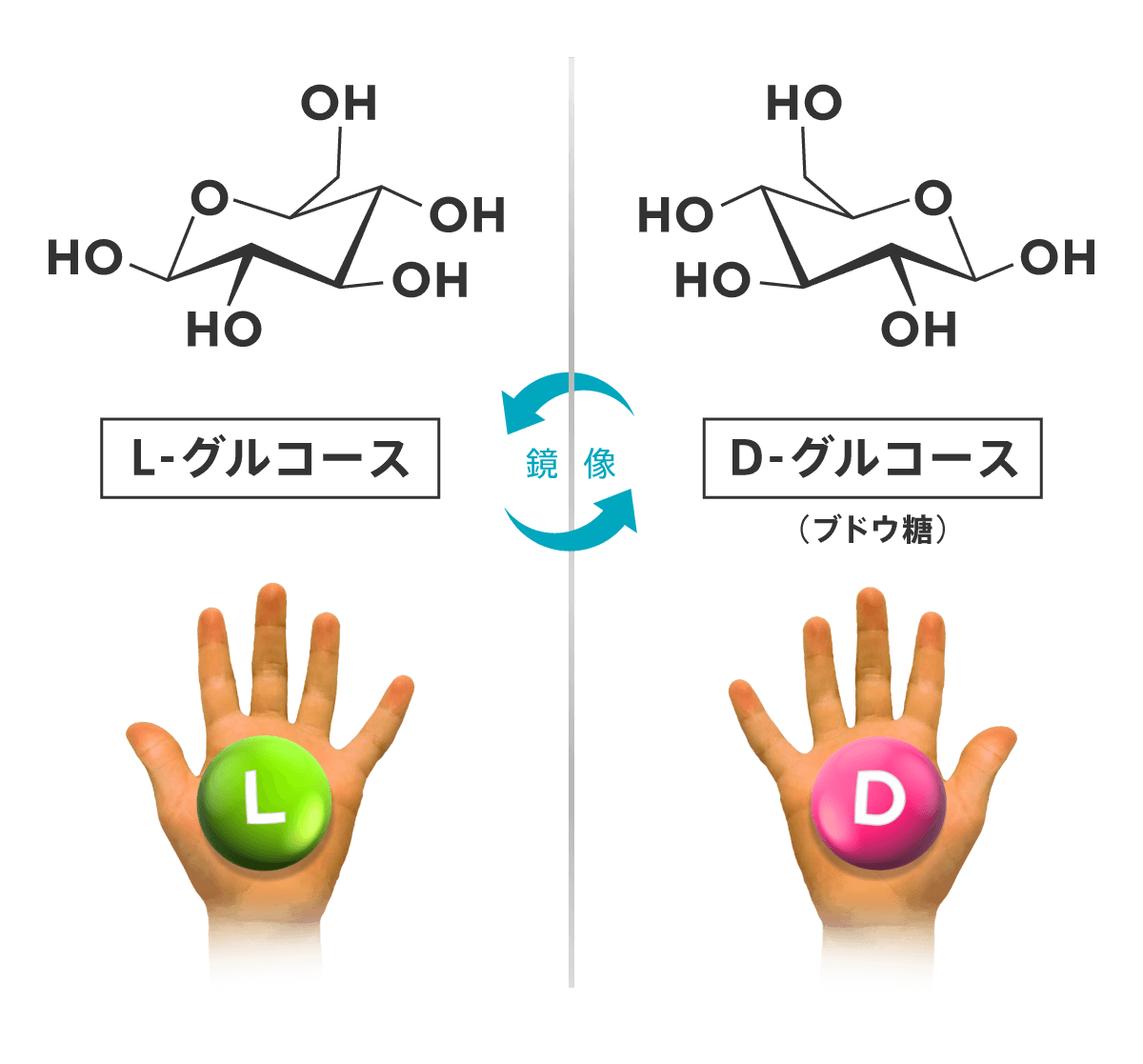
【図2】 D-グルコース(右)とL-グルコース(左)の化学構造。互いに鏡で写した構造をしている。
オルバイオ株式会社(ORBIO Corporation)は、この発見に基づいてL-グルコースを「木馬」分子とすることにより、第5のがん治療法をさらに一歩進める新しい治療法を開発しています。L-グルコースと適切に設計された「武器」分子とを結合させた新しい分子をオルバイオ分子と名付けます。このオルバイオ分子はがん細胞に対してこれまでにない高い選択性をもって取り込まれます。上手に設計された「武器」分子を引く「木馬」としてのL-グルコースは、がん細胞に取り込まれ、「武器」分子はたくさん内部に溜め込まれることになります。細胞内に侵入した武器分子は細胞毒性を発揮しますが、更に積極的に物理的方法を用いて「武器」分子を活性化させることにより、がん細胞を退治してがんを完治させる。これがオルバイオ分子によるがん征圧です。
このオルバイオ分子を用いるがん征圧法、すなわち「オルバイオ法」の第1の特徴は、がん選択性が極めて高いことです。L-グルコースは、正常細胞には取り込まれません。しかし、これまでに調べた限りの腺がん細胞、とりわけ膵臓がん・胆道がんなどの難治性のがんや、予後不良の肉腫・卵巣がん・子宮体がんや胃がんなどの患者様のがん細胞に高い選択性をもって取り込まれました。また、この取り込みは【図3】で示すように、がん細胞に特異的に発現するチャネル様タンパク(Channel-Like Protein)(*6)を介して起こると考えられます。
がん細胞だけがL-グルコースを取込む
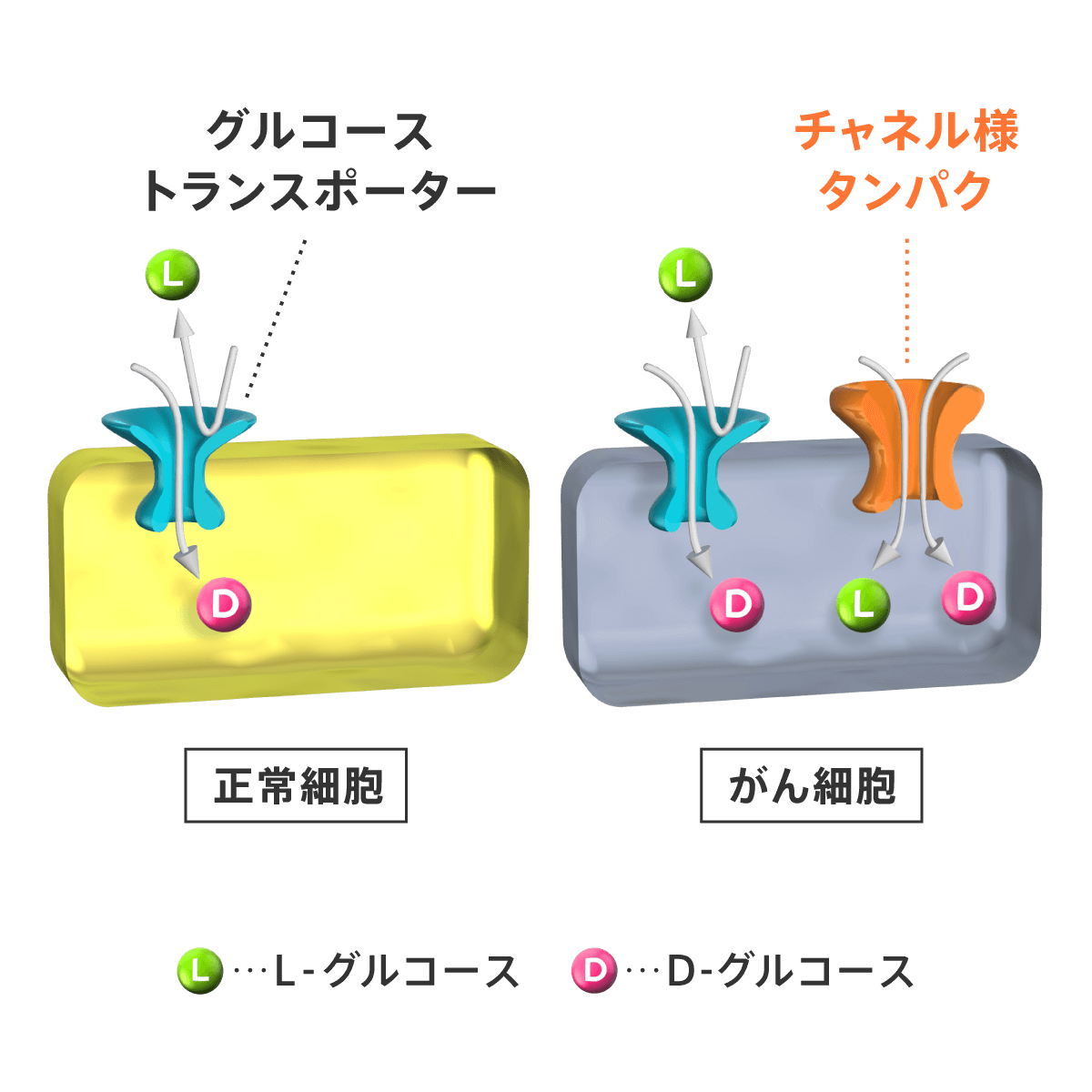
【図3】 L-グルコースが、がんだけに取り込まれる仕組み。がん細胞には、通常のグルコース・トランスポーター(*5)の他に、チャネル様タンパク(Channel-Like Protein)(*6)と呼ばれる、がん細胞にだけL-グルコースが入る入り口がある。
「オルバイオ法」の第2の特徴は、外科手術のようにがんがある程度大きくなってから除去する方法とは異なり、たった1個の細胞であっても「トロイの木馬」が効果を発揮し、がん細胞を消失させることができることです。つまり細胞単位で治療が可能な方法です。
そのため非常に早期のステージと診断され、その後急速に進行するようながんを、PETやCT、MRIなどの最新の診断法を用いても見つからない段階で治療することが可能になります。さらには発見が遅く、ステージ4でがん細胞が切除不能進行・再発となった場合や、転移巣が小さすぎてPETなどを用いる画像検査では発見できない場合でも、そのがん細胞がどこに潜んでいようとがん細胞が増殖するために格別に栄養素を求めている限り、その性質を逆手にとって「武器」分子を送り込むことができます。
【図4】に、緑色の蛍光基を結合したL-グルコースが、膵臓の細胞のうち、悪性の性質を示す腫瘍すなわちがん細胞に選択的に取り込まれて緑色に光る実験例を示します。
がん細胞に選択的に取込む実験
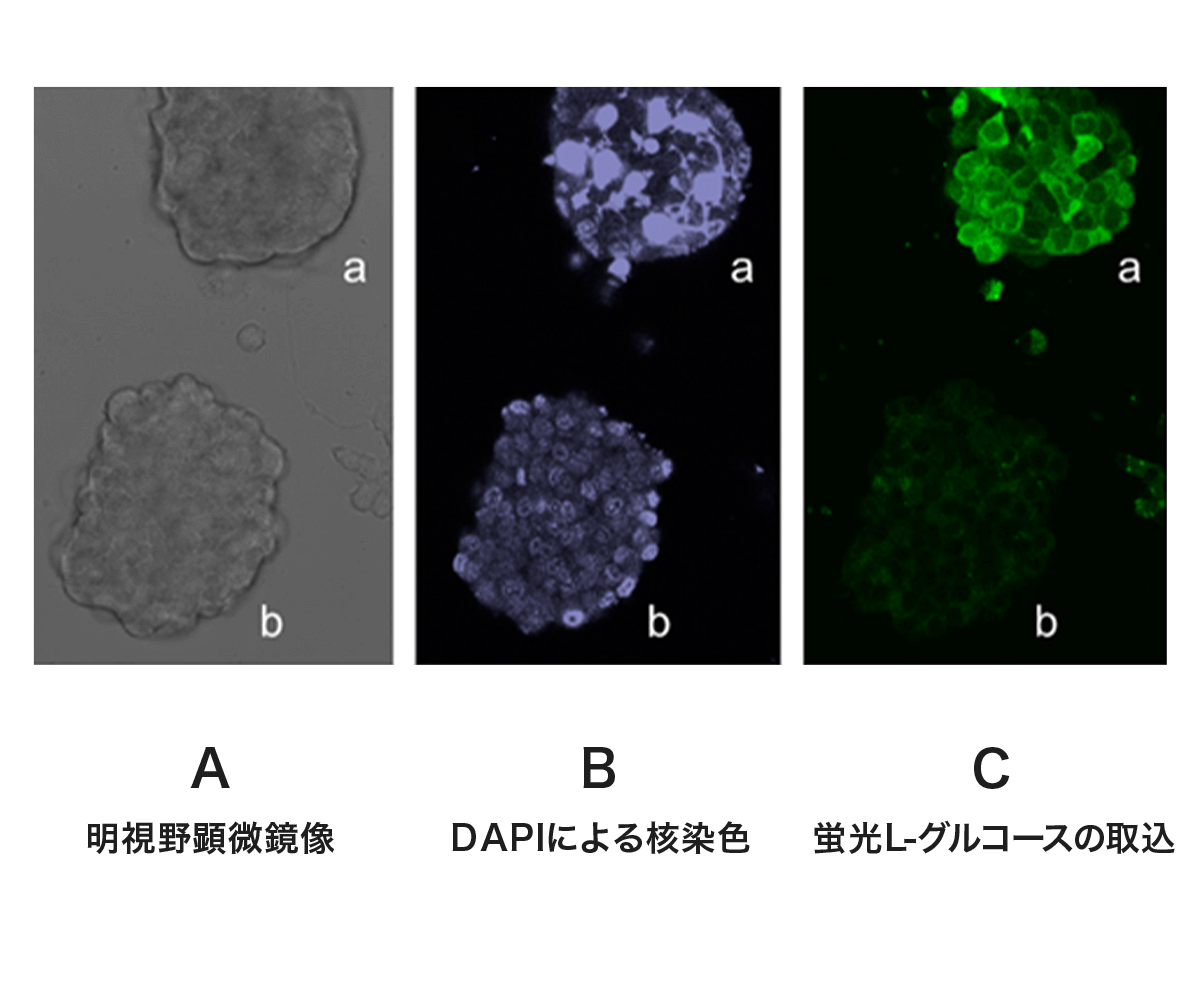
【図4】マウス膵臓の腫瘍細胞からなる塊aおよびbのうち(図A)、悪性腫瘍の特徴を示す大小不同の核異型(図B)を呈するaのみが、蛍光L-グルコースを細胞内に強く取り込み(図C)、正常細胞もしくは良性腫瘍の特徴(図B)を示すbは、蛍光L-グルコースを取り込まない(図C) 。(Sasaki A. et al., Human Cell 29: 37-45, 2016より)
抗がん剤候補の発見① CLG
オルバイオ法の第1の分子は、がん細胞が選択的に取り込むL-グルコースを「木馬」分子とし、ニンジンやパセリ、みかんなどに含まれる天然物7-OH-クマリン(Coumarin)を「武器」分子とする新物質です。これをCLGと名付けました。CLGは、がん細胞に選択的に取り込まれて青色蛍光を発するとともに、がん細胞の核に取り込まれて、がん細胞の増殖を阻害します。
CLGの分子構造を、【図5】に示します。この図から分かるように、CLGは、L‐グルコースに7-OH-クマリン(Coumarin)が窒素を介して強固に結合する構造をしています。クマリン(Coumarin)構造は、青色蛍光を発するとともに、がん細胞の核に取り込まれてがん細胞の増殖を阻害します。
培養がん細胞を用いてその細胞塊の増殖の時間変化を観察したところ、CLGを投与しないときは、細胞塊の面積は時間経過とともに増大するのに対して、CLGを投与するとその濃度の増加に依存して腫瘍の増殖が抑制され、細胞塊の崩壊が認められました。L-グルコース誘導体であるCLGは、正常細胞に取り込まれないばかりか、がん細胞の代謝異常(Warburg効果)を捉える選択性が極めて高い抗がん剤として期待されます。
CLGの分子構造
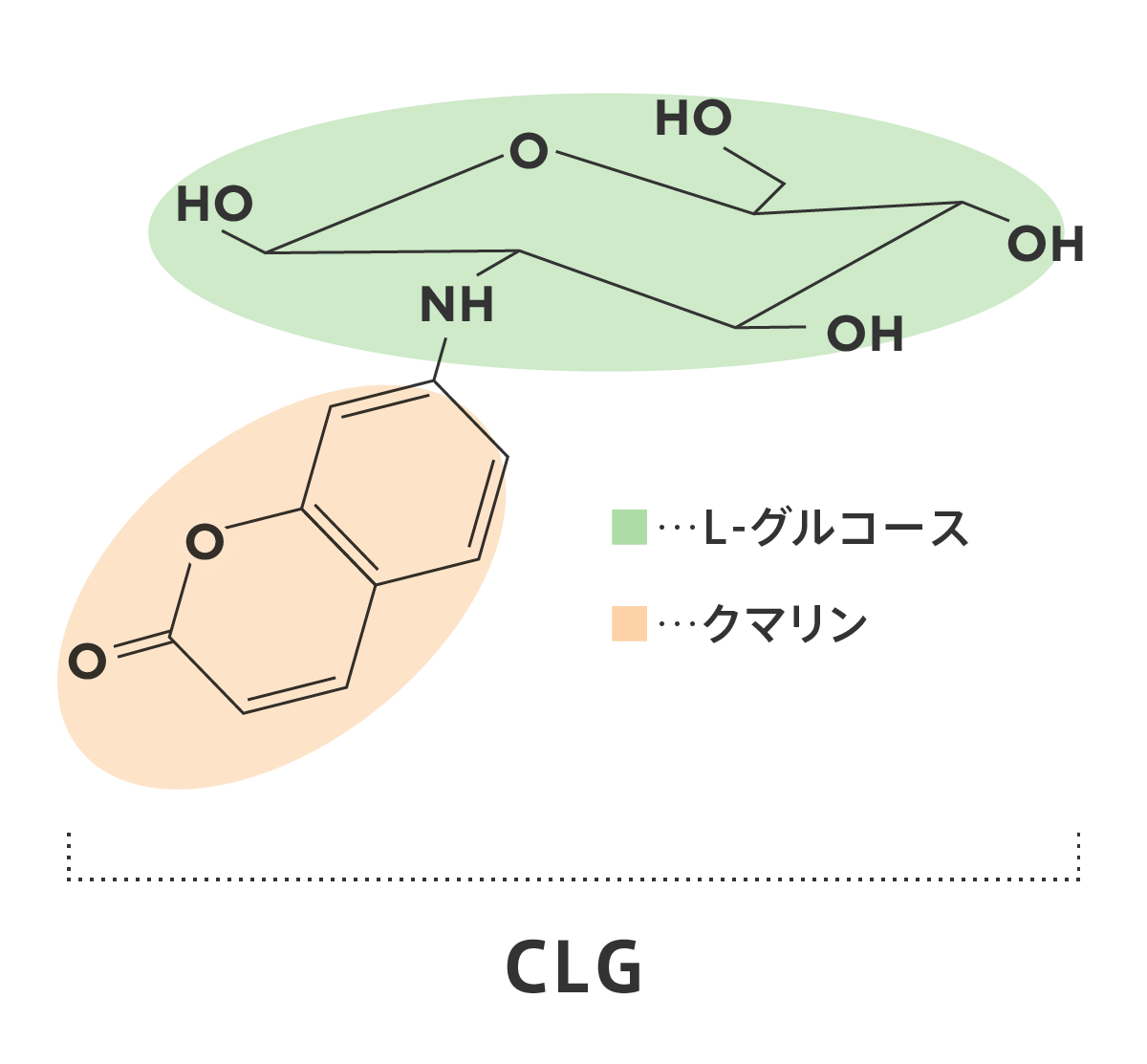
【図5】 CLGの分子構造。L-グルコースに7-OH-クマリン(Coumarin)が窒素を介して強固に結合している。
抗がん剤候補の発見② ALG
オルバイオ法の第2の分子は、がん細胞が選択的に取り込むL-グルコースを「木馬」分子とし、金原子(Au)を含む有機化合物を「武器」分子とする新物質です。これをALGと名付けました。ALGは、細胞死をもたらします。
がん細胞が特異的にL-グルコースを細胞内に取り込むその選択性に着目して、金(Au)原子をL-グルコースに硫黄原子(S)を介して結合させた新物質をつくり、これをALGと名付けました【図6】。すると、ALGは細胞毒性をもたらすことを見出しました。こうしてALGは、がん細胞選択性が極めて高い抗がん剤として期待されます。 さらに、がん細胞に金原子(Au)が蓄積すれば、体外から高周波をスキャンさせると、金(Au)の蓄積したがん細胞のみが高周波によって発熱することが期待されます。こうして、がん細胞のみを43℃程度にし、正常細胞を37℃以下に抑えることができれば、がん細胞を確実に死滅させることが期待されます(高周波ハイパーサーミア療法)。
ALGの分子構造
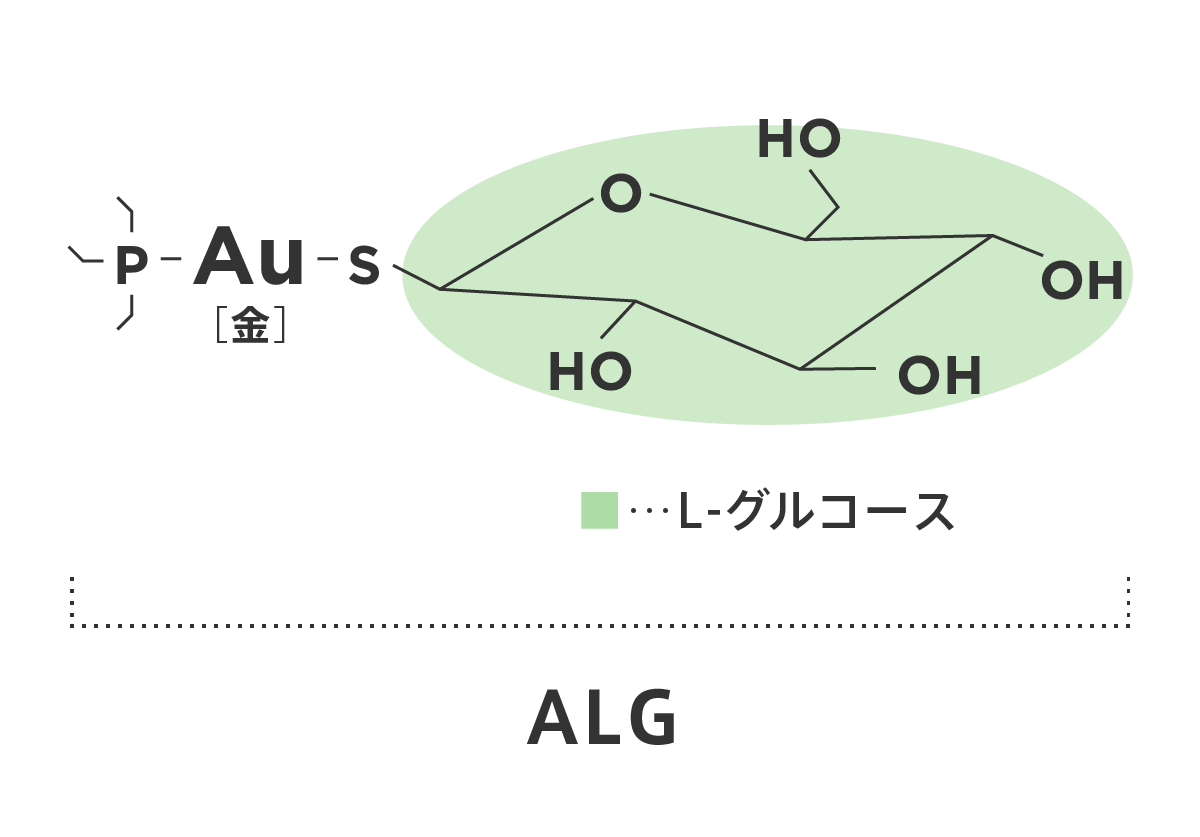
【図6】 ALGの分子構造。L-グルコースに金(Au)原子が硫黄(S)原子を介して強固に結合している。
既存の抗がん剤との違い
オルバイオ分子は、明確に役割分担されている2つ以上の分子の結合物質であり、正常細胞にはダメージを与えずに、がん細胞にだけ作用するように設計されます。
第5のがん治療法としてのオルバイオ法は、オルバイオ分子を用いて物理・化学的方法でその分子の一部を活性化させてがんを退治する方法ですから一見、標準治療における抗がん剤による第2の方法との区別がつきません。 しかし、抗がん剤による第2の方法は、がん細胞も正常細胞も無差別に攻撃してがん細胞の増殖や転移を抑える治療薬であるため、正常細胞に対しても深刻な副作用をもたらします。すなわち、一般に抗がん剤は、有効な効果が現れる量と、副作用の現れる量が極めて接近しています。抗がん剤の中でも「分子標的治療薬」は特定のがん細胞に特異的に発現する分子に作用することで、がんの増殖を抑制する治療薬であることから、従来の抗がん剤と比較して副作用が小さいとされていますが、膵臓がんの最新の10年生存率がわずか6.8%であることからもわかるように、十分な効果を発揮しません。また免疫チェックポイント阻害剤のような新しい「分子標的薬」は、実際には正常細胞にも影響して、予想できない副作用が現れることがあります。 オルバイオ分子は、がんに選択的に取り込まれる分子(「木馬」)を、がんを光らせたり退治したりする分子(「武器」)と結合する明確なコンセプトに基づいて設計されており、前者の「木馬」分子は毒性が実質上ないと言ってもよい、正常細胞には働かない安全な糖L-グルコースを用いるため、副作用の潜在性を考えうる限り小さく抑えることができます。
